Exercise-mediated epigenetic modifications in cardiovascular diseases

心血管疾病(CVDs)是全球发病率和死亡率的主要驱动因素,随着人口老龄化,预计其负担将在2025年至2050年间进一步加重。研究表明,CVDs的普遍发生与体力活动不足和久坐生活方式的增加密切相关。这些因素不仅是心血管健康受损的独立预测指标,也是包括CVDs在内的多种慢性疾病的可调节风险因素。因此,预防CVDs的关键在于关注可改变的生活方式和健康行为,其中规律的身体锻炼被认为是核心组成部分。大量证据表明,规律的运动能够减少心脏代谢风险因素并改善临床结果,同时在CVDs的临床干预和多种临床前模型中也显示出显著的益处
基于这些发现,研究逐渐聚焦于运动对心血管益处的具体机制,旨在制定基于证据的运动干预策略、确定潜在的治疗靶点,并探索开发模拟运动药物的可行性。表观遗传学作为一种关键的调控机制,能够在不改动DNA序列的情况下调节基因功能、表达或活性,在CVDs的进展或改善中扮演重要角色。越来越多的证据表明,运动对CVDs的防御作用至少部分由表观遗传机制驱动。目前认为,运动的表观遗传效应通过减轻炎症、改善代谢和维持氧化还原稳态,在CVDs的一级和二级预防中发挥关键作用。然而,具体的分子机制尚未完全阐明。此外,运动诱导的表观遗传效应具有系统性和组织特异性,可能不仅影响心脏,还可能影响其他组织或促进器官间通信。对这些过程的深入理解不仅有助于揭示心血管治疗靶点,还可能为应对合并症提供重要见解。
本文旨在全面综述运动对CVDs表观遗传影响的最新研究进展。具体而言,文章将探讨不同运动强度下运动触发的表观遗传改变对心脏保护的意义,并分析运动介导的DNA甲基化、乳酸化修饰(包括组蛋白和非组蛋白)以及m6A RNA修饰之间的相互作用,阐明它们在心脏保护中的作用。此外,研究还将探讨运动触发的表观遗传变化对合并症发展的影响。总体目标是突出运动介导心血管保护中表观遗传通路的最新进展、挑战和未来研究方向。
这些发现表明,运动介导的表观遗传修饰在CVDs的预防和合并症管理中具有潜在的治疗前景。然而,这些效应的异质性和组织特异性要求更针对性的研究,以充分释放其治疗潜力。
运动介导的表观遗传修饰机制
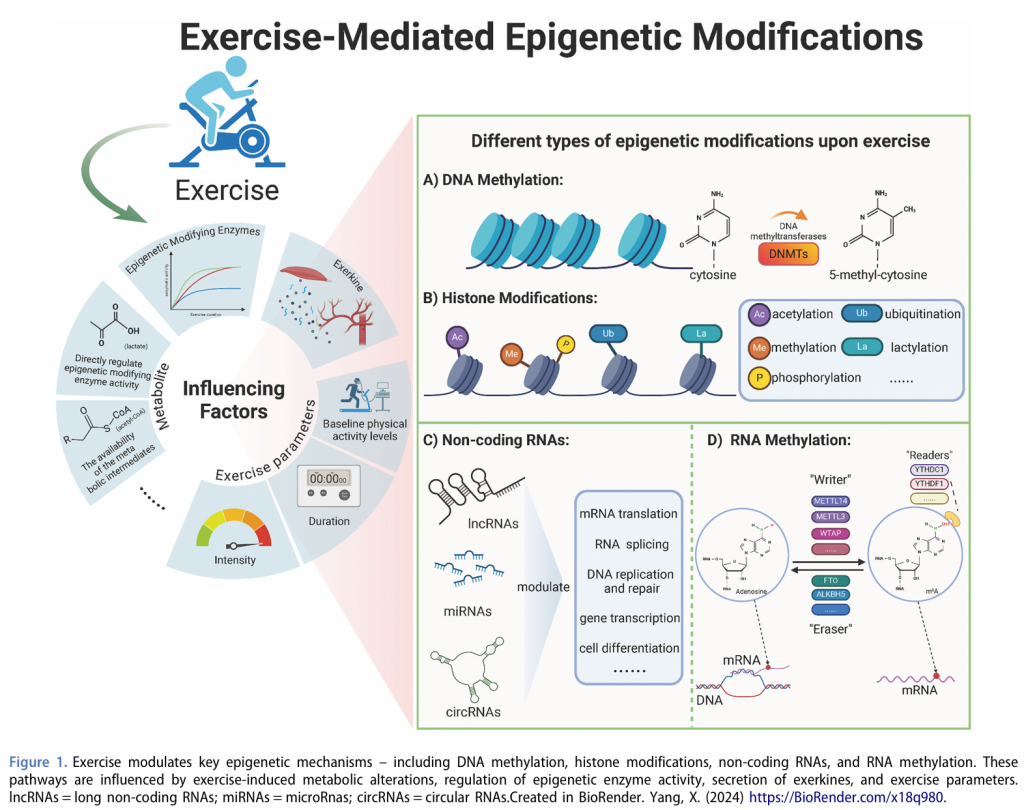
运动介导的表观遗传调控机制涉及多个关键方面,包括DNA甲基化、组蛋白修饰、非编码RNA(ncRNA)以及RNA甲基化。运动通过改变代谢通量或直接影响表观遗传修饰酶的代谢物,从而调节这些修饰所需的中间产物的可用性。此外,运动触发的信号通路变化也可能直接调控这些酶的活性。运动因子(exerkines)以及运动的强度和持续时间等因素在塑造这些表观遗传修饰中起着关键作用。
DNA甲基化
DNA甲基化是最早被发现的表观遗传调控机制之一,主要涉及DNA甲基转移酶(DNMTs)催化将活性甲基转移到CpG二核苷酸中的胞嘧啶碱基上,形成5-甲基胞嘧啶(5mC)。DNMT1主要负责在DNA复制和修复过程中维持甲基化模式,而DNMT3家族成员(包括DNMT3a、DNMT3b和DNMT3L)则参与从头甲基化,将未甲基化的CpG位点转化为甲基化状态。研究表明,运动能够显著改变DNA甲基化水平。特定CpG位点的甲基化水平与基因表达之间的相关性受到多种因素的影响,包括运动期间释放的循环因子(如激素)、基因组区域的现有表观遗传景观(如启动子区域的核小体定位)、人口或遗传因素(如性别、家族史)以及运动参数(如强度、持续时间、基线体力活动水平)。
组蛋白修饰
组蛋白修饰包括组蛋白蛋白(H2A、H2B、H3和H4)的翻译后修饰(PTM),如乙酰化、甲基化、磷酸化、泛素化和乳酸化。这些修饰通过改变染色质的压缩状态和DNA的可及性来调控基因表达。近年来,一种新型的PTM——组蛋白乳酸化被发现,其通过乳酸代谢产物乳酸-CoA修饰组蛋白上的赖氨酸残基。乳酸是丙酮酸代谢的副产物,在高强度运动期间显著增加,并刺激组蛋白乳酸化。研究表明,组蛋白乳酸化在多种生理过程中发挥关键作用,例如通过乳酸化调控小胶质细胞极化,从而减轻神经炎症并增强认知功能。此外,内皮细胞内的糖酵解活性通过组蛋白乳酸化促进骨间充质干细胞的成骨分化,提示运动诱导的血清乳酸水平升高可能与骨质疏松的改善有关。由于运动能够提高动脉乳酸水平并增加心脏对乳酸的摄取,未来研究应进一步探讨运动诱导的组蛋白乳酸化对心脏病理生理途径的影响。
非编码RNA
ncRNA包括微小RNA(miRNA)、长链非编码RNA(lncRNA)和环状RNA(circRNA),已被广泛研究为多种细胞类型和组织中生物过程的关键调控因子,其失调与多种疾病相关。miRNA是由RNA聚合酶II转录为初级miRNA并随后加工为成熟miRNA的短RNA分子(20-25个核苷酸),通过靶向mRNA进行降解或翻译抑制来调控基因表达。miRNA在运动适应、心脏和骨骼肌肥大、血管生成、动脉粥样硬化和代谢过程中发挥重要作用。lncRNA长度超过200个核苷酸,缺乏显著的蛋白质编码能力,但在基因调控中发挥重要功能。运动能够调节lncRNA的表达和功能,例如心脏生理性肥大相关调控因子(CPhar)在运动触发的心脏增大中起关键作用。circRNA是单链共价闭合的RNA分子,作为转录调控因子和miRNA海绵发挥作用。circRNA有助于心脏稳态和CVDs的预防,其表达水平在运动后发生变化。研究表明,运动诱导的circRNA能够促进生理性心脏肥大并保护心脏免受缺血-再灌注损伤。
RNA甲基化
m6A是指在腺苷的氮-6位点上的甲基化,是真核细胞中最常见和丰富的RNA甲基化形式。该修饰由甲基转移酶复合物(如METTL3、METTL14和WTAP)催化,而去甲基化酶(如FTO和ALKBH5)则去除m6A标记。m6A结合蛋白(如YTH结构域蛋白)介导下游效应,调控RNA的稳定性、剪接、运输和翻译。m6A甲基化已被确定为CVDs中的关键调控机制。大多数研究表明,运动后m6A甲基化水平降低,从而通过调节生理性肥大、减轻缺血-再灌注损伤、抑制心脏重塑和动脉粥样硬化进展来促进运动诱导的心脏保护作用。
总结
总之,表观遗传修饰机制具有高度多样性,运动诱导的表观遗传修饰不仅限于上述例子。其他修饰,如腺苷到肌苷(A-to-I)RNA编辑,也被证明与运动调控相关。增强对这些修饰机制的理解对于揭示基因表达和运动生理反应的复杂调控至关重要。未来的研究应继续探讨这些机制如何相互作用,以揭示运动在改善健康和预防疾病中的整体优势。
运动强度差异与表观遗传效应的关系
运动分类的研究始于20世纪中期,最初主要根据运动的形态特征或主要活动形式进行分类。例如,运动被分为耐力活动(如跑步和游泳)和力量活动(如举重和摔跤)。随后,Jere H. Mitchell及其同事提出了一种基于心血管负荷的分类系统,根据运动的动态和静态成分对运动进行分类。这一方法至今仍是心血管风险评估的基石。随着运动科学的发展,运动强度的分类逐渐变得更加精细,采用了代谢当量、心率、耗氧量和主观疲劳评分等指标,这些参数能够更精确地评估运动对身体的生理影响。
不同强度的运动对心血管健康的影响各不相同。低强度活动(如步行和太极)通常被认为对心血管系统的负荷较轻。然而,基于人类研究的荟萃分析表明,长期坚持此类活动能够显著降低心血管事件的风险。此外,低至中等强度的运动与内皮功能的改善相关,突显了其血管益处。在动物模型中,低强度运动通过多种机制表现出心脏保护作用,包括改善代谢综合征、增强心肌收缩功能和肾上腺素能反应性。然而,低强度运动介导的表观遗传效应仍知之甚少。尽管有证据表明低强度运动可能诱导表观遗传变化(例如,较高的正常步行速度与四种经典表观遗传时钟加速的减缓相关),但这些修饰可能比中等或高强度运动触发的变化更为微妙或缓慢。这一因素可能导致该领域的研究有限,需要更长期或更敏感的研究来揭示这些效应。
中等强度运动(如跑步、快走和爬楼梯)被广泛推荐用于预防CVDs。这些活动显示出与心脏代谢结果最强且最省时的保护性关联。其心血管保护作用已通过人类和动物研究得到广泛记录,通过减少炎症、增强内皮功能、维持氧化还原平衡和改善代谢功能等机制实现。此外,中等强度的抗阻或有氧训练通过表观遗传调控机制对身体产生多种影响,包括减少氧化应激、维持氧化还原稳态、调节自主神经功能和调控免疫反应等。
高强度间歇训练(HIIT)因其心血管益处而受到广泛关注,通常被认为是中等强度持续训练(MICT)的有效替代方案。HIIT和MICT均能改善心血管健康,尽管可能通过不同的保护机制实现。HIIT以短时间高强度活动后休息或低强度运动为特征,在人类和动物研究中均显示出比MICT更显著的线粒体生物合成和氧化代谢效应。HIIT引起的高代谢应激可能触发独特的表观遗传修饰,如组蛋白乙酰化或乳酸化模式的变化,这些修饰可能在调节心血管保护相关基因表达中发挥作用。
尽管不同强度的运动均能带来有益的心血管结果,但未来研究仍需进一步探讨不同强度水平对表观遗传变化的长期影响及其在疾病预防中的个体贡献。
运动介导的表观遗传效应与心血管疾病进程的密切关系
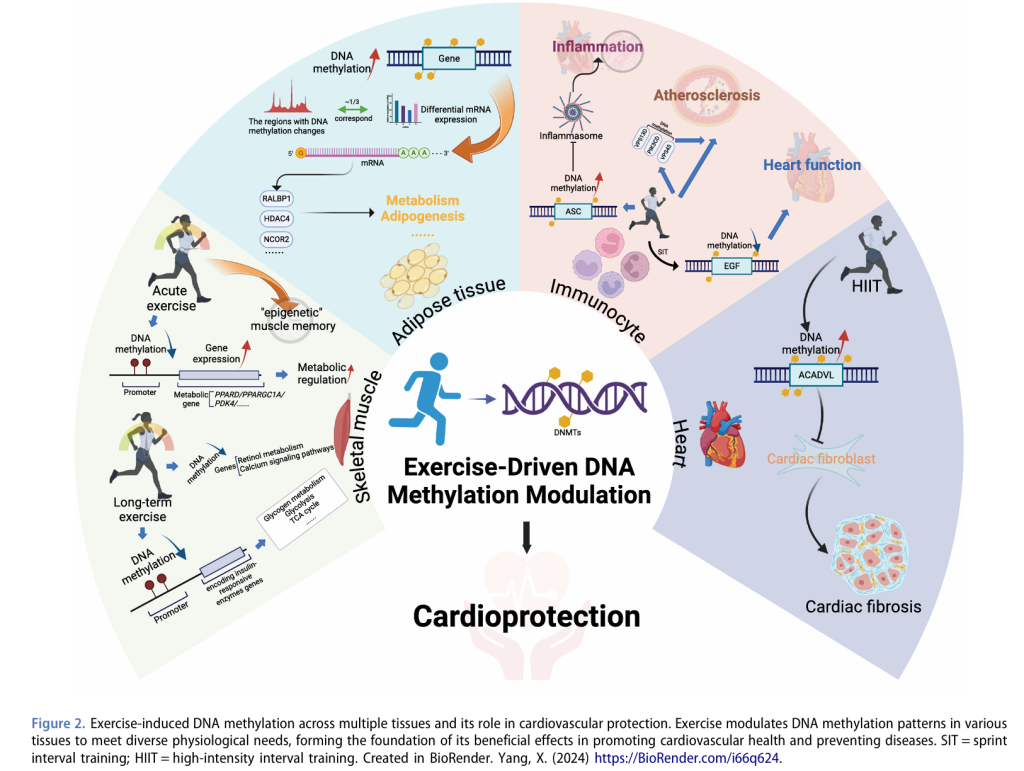
4.1 运动驱动的DNA甲基化:心脏特异性调控能否对抗心血管病理?
DNA甲基化已成为CVDs中的关键因素,通过调控基因表达影响多种生物过程。异常的DNA甲基化模式在冠状动脉疾病(CAD)、动脉粥样硬化、心脏肥大、心力衰竭(HF)和高血压中广泛报道。此外,基于已知的CpG甲基化位点,系统综述和数据库的开发进一步探索了DNA甲基化与CVDs之间的关联,推动了基于DNA甲基化的诊断生物标志物或预测模型的进展。DNA甲基化不仅作为被动标志物,还积极参与心血管表型的塑造。它通过多种方式影响疾病反应:一方面,体外研究表明,DNA甲基化直接影响心肌细胞,其中DNA甲基转移酶(DNMTs)在心肌细胞代谢和收缩功能中起关键作用。在大鼠模型中,抑制DNMTs可缓解压力超负荷下的心脏功能障碍。另一方面,DNA甲基化还调控与炎症、脂质代谢和血管功能等关键心血管风险因素相关的基因。例如,高同型半胱氨酸血症诱导的DDAH2启动子甲基化与CAD患者的内皮功能障碍相关,促进动脉粥样硬化。心肌和非心肌细胞中的DNA甲基化效应可能通过复杂的系统机制相互关联,但尚不清楚这些心脏和系统效应之间是否存在双向反馈循环。阐明这一关系可能是理解运动干预如何通过调节DNA甲基化实现CVDs治疗益处的关键。
由于DNA甲基化主要由环境因素(如压力、体力活动、饮食和吸烟习惯)驱动,运动在调节DNA甲基化以降低CVDs风险中的作用尤为重要。此外,急性心血管事件(如心肌梗死)本身也可诱导DNA甲基化变化。作为CVDs的一级和二级预防方法,运动通过多种生物途径的DNA甲基化变化发挥作用。研究表明,运动通过DNA甲基化影响骨骼肌代谢相关基因的表达,介导心脏保护作用。高强度运动后,代谢基因启动子(如PPARGC1A、PPARD和PDK4)表现出低甲基化,导致基因表达增加和代谢调控增强。此外,运动还通过调节免疫细胞中的DNA甲基化减少炎症反应。例如,在HF患者中,运动与ASC基因甲基化增加相关,减少IL-1β和ASC mRNA表达,从而通过表观遗传调控炎症小体形成减少炎症。尽管这些研究揭示了运动如何影响心血管风险,但运动对心脏组织特异性DNA甲基化的直接影响仍需进一步探索。
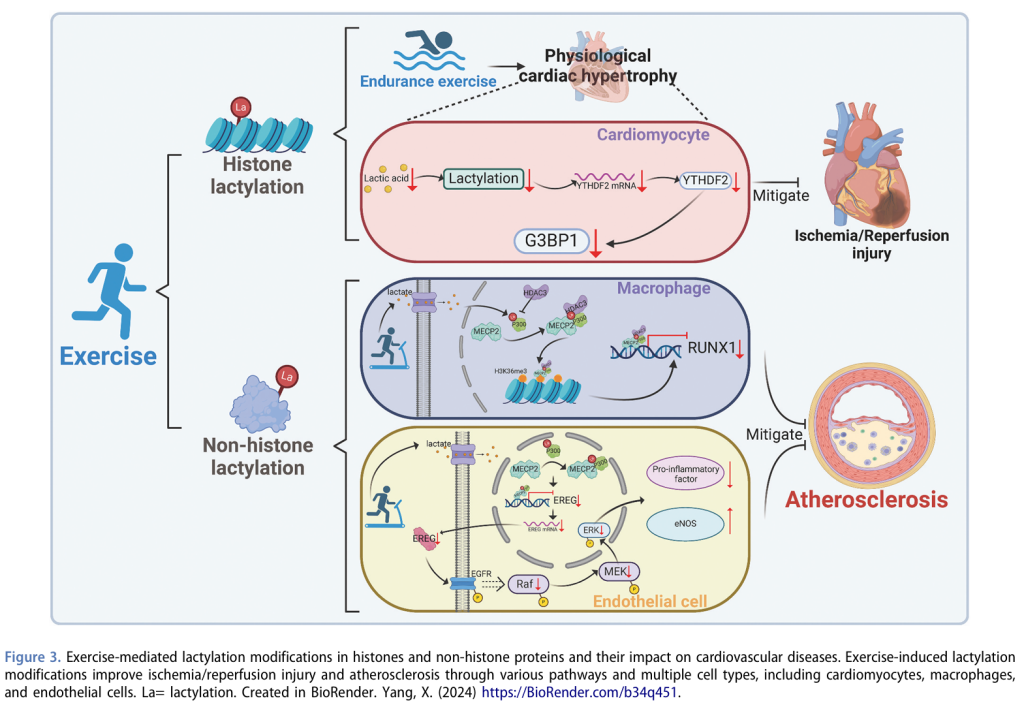
4.2 运动诱导的乳酸化修饰:心血管疾病中的新型表观遗传前沿
如前所述,运动是乳酸化修饰的关键潜在调节因子,能够影响组蛋白和功能蛋白的修饰。近年来,越来越多的研究揭示了乳酸化修饰在CVDs进展中的重要性,其中多项研究直接探讨了运动诱导的乳酸化修饰的作用。
在肿瘤细胞中,即使在氧气充足的环境中,糖酵解也被优先用于产生大量乳酸,这种现象被称为“瓦伯格效应”(Warburg effect)。历史上,乳酸仅被视为糖酵解的副产物,直到2019年,Zhao等人发现乳酸在代谢中的积累可以作为组蛋白赖氨酸乳酸化的底物。这一发现揭示了细胞代谢与表观遗传调控之间的联系,特别是在细菌感染期间通过影响M1巨噬细胞的稳态来实现。在心血管疾病领域,作者的研究团队首次报道了组蛋白乳酸化在心肌梗死(MI)中的作用。具体而言,在小鼠MI模型中,作者的研究团队发现组蛋白乳酸化促进了修复基因的转录,调节单核-巨噬细胞在炎症消退和血管生成中的双重活性,从而增强修复环境并改善梗死后的心脏功能。机制研究表明,细胞内代谢重编程和单羧酸转运蛋白1(MCT1)介导的乳酸转运驱动了组蛋白乳酸化,而GCN5(general control non-depressible 5)作为乳酸化的“写入者”,促进了目标基因的转录。然而,运动在心脏蛋白乳酸化中的作用及其功能后果仍未被充分探索。最近的一项小鼠研究表明,长时间的耐力运动减少了心肌乳酸的积累,从而降低了心脏乳酸化水平。YTH结构域家族蛋白2(YTHDF2)对心脏乳酸化的变化敏感,介导了运动诱导的生理性心脏肥大。抑制YTHDF2通过一种非RNA m6A依赖的机制(涉及Ras GTP酶激活蛋白结合蛋白1,G3BP1)减轻了缺血-再灌注损伤诱导的心力衰竭(HF)。这一研究推进了我们对运动调节组蛋白乳酸化在心血管健康中影响的理解。然而,仍需进一步研究不同运动强度或短期运动通过乳酸化对心血管系统的影响。这些研究有望增强我们对运动如何调节组蛋白修饰的认识,从而深化对运动与心血管健康之间复杂相互作用的理解。
与组蛋白修饰相比,非组蛋白修饰通常对细胞功能具有更直接和精确的影响。例如,最近的动物研究表明,运动介导的乳酸化在神经元活动和心血管系统中发挥关键作用。运动显著改变了突触体相关蛋白91(SNAP91)在赖氨酸885位点的乳酸化,增强了内侧前额叶皮层的突触结构和神经元活动,从而提高了对慢性束缚应激的抵抗力。类似地,线粒体丙氨酰-tRNA合成酶2(AARS2)的乳酸化与肌肉运动相关,运动期间的缺氧条件诱导了AARS2的乳酸化,通过抑制线粒体氧化磷酸化来防止过度运动引起的损伤。在CVDs中,乳酸代谢失调与疾病进展密切相关。在动脉粥样硬化中,颈动脉粥样硬化患者的血液乳酸水平可能显著升高,斑块的过度积累进一步加剧了乳酸浓度的增加。因此,研究乳酸化在动脉粥样硬化中的作用具有重要意义。基于此,我们研究了运动介导的乳酸化在动脉粥样硬化中的作用,并确定了甲基-CpG结合蛋白2(MECP2)作为关键分子。MECP2是一种对甲基化CpG岛具有高亲和力的核蛋白,参与转录抑制或激活以及染色质结构调控。我们的研究发现,运动增加了小鼠MECP2在赖氨酸271位点的乳酸化,调节内皮细胞中多种炎症分子的表达,同时上调eNOS水平,显著抑制动脉粥样硬化的进展。这一过程主要通过抑制Ereg基因及其调控的MAPK信号通路实现。另一项研究聚焦于巨噬细胞(动脉粥样硬化斑块中的另一种关键细胞类型),发现运动诱导的MECP2 K271乳酸化促进了M2巨噬细胞极化,增强了斑块的稳定性,减少了斑块中的脂质沉积和坏死核心区域。这一过程由MECP2 K271乳酸化和H3K36me3的协同作用驱动,通过抑制RUNX1基因表达增加了染色质的可及性并调控巨噬细胞功能,为运动缓解动脉粥样硬化提供了新的机制。
总之,我们的研究为运动介导的乳酸化与心血管保护之间的联系提供了新的见解,突显了乳酸化在动脉粥样硬化中的关键作用。有趣的是,基于上述三项研究运动与乳酸化在CVDs中作用的动物研究,不同运动强度对乳酸代谢产生了显著相反的影响。这些发现强调了运动强度与乳酸化相关通路之间的复杂关系,表明运动强度在调节乳酸代谢及其下游表观遗传效应中的关键作用。未来的研究应致力于阐明特定运动方案对乳酸化及其心血管益处的影响,从而推动基于运动的靶向治疗策略的发展。
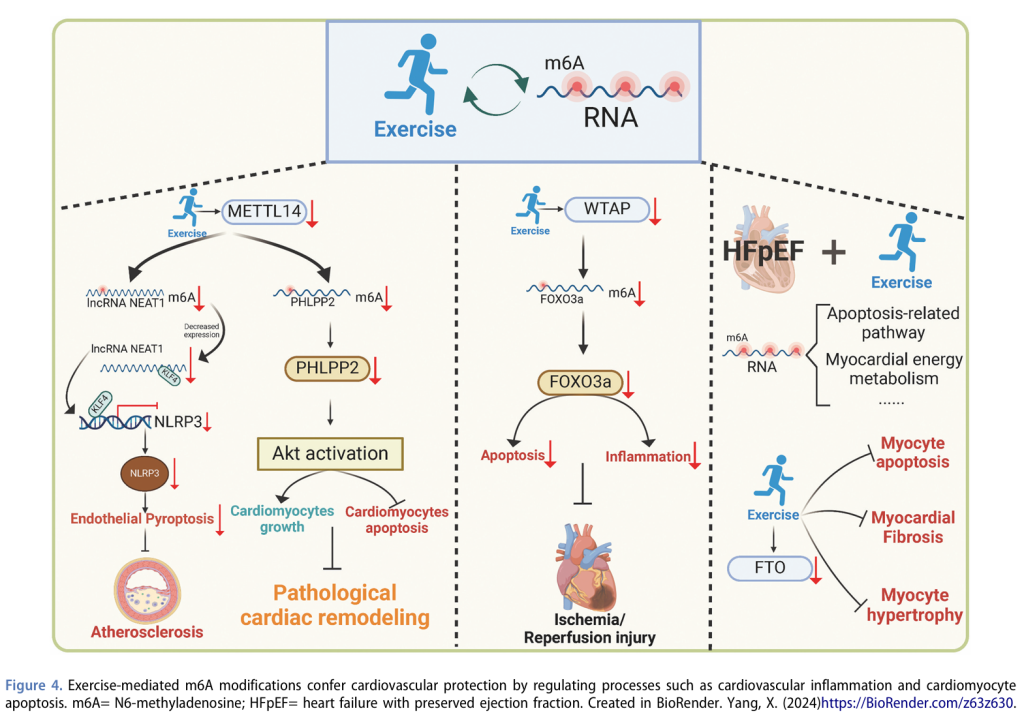
4.3 运动诱导的m6A RNA修饰:调控心血管炎症和心肌细胞凋亡的关键?
近年来,RNA修饰在CVDs发展中的作用引起了广泛的研究兴趣。Junjie Xiao等人最近的一篇综述详细讨论了运动如何通过调节miRNA、lncRNA和circRNA等RNA修饰来改善心脏功能、促进心脏修复和抑制纤维化,特别是运动诱导的m6A和A-to-I编辑修饰。鉴于CVDs机制的日益复杂性,本文的重点不是重复已有讨论,而是深入探讨运动诱导的m6A RNA修饰在调控心血管炎症和细胞凋亡过程中的作用。这些机制有望重塑我们对运动在心血管健康中系统性影响的理解,并揭示新的治疗思路。
m6A是真核细胞中最常见的RNA内部修饰,调控包括免疫反应和炎症在内的多种生理和病理过程。在动脉粥样硬化中,m6A修饰已成为免疫细胞行为的关键调控因子。最近的研究,包括我们自己的研究,表明m6A“书写者”METTL14在调控巨噬细胞介导的炎症中起关键作用。具体而言,敲低METTL14会抑制Myd88 mRNA的稳定性,抑制p65核转位,从而减少IL-6的表达,促进M2巨噬细胞极化。这种从促炎性到抗炎性巨噬细胞活性的转变不仅减弱了泡沫细胞的形成,还显著延缓了动脉粥样硬化斑块的进展。因此,METTL14成为动脉粥样硬化治疗的一个潜在靶点。在此基础上,核旁斑组装转录物1(NEAT1)——一种与CVDs相关的关键lncRNA——为炎症调控提供了另一层复杂性。研究表明,NEAT1不仅通过表观遗传调控因子EZH2促进血管平滑肌细胞(VSMC)表型转换和血管钙化,还通过影响巨噬细胞活性和T细胞分化调控动脉粥样硬化和心肌梗死(MI)中的免疫反应。这些发现突显了NEAT1在心血管病理生理学中的多样性和关键作用。更重要的是,METTL14与NEAT1之间的调控关系将运动诱导的RNA修饰置于这两种机制的交叉点。我们的研究团队发现,运动通过减少METTL14催化的m6A修饰下调lncRNA NEAT1,从而在抑制内皮细胞焦亡和延缓动脉粥样硬化进展中发挥关键作用。从机制上讲,METTL14结合NEAT1上的m6A位点,促进其表达,并促进YTH结构域蛋白1(YTHDC1)的识别,后者通过KLF4/NLRP3轴增强内皮细胞焦亡。因此,通过运动下调NEAT1,METTL14-NEAT1轴被破坏,有效抑制了这一焦亡通路,从而减少炎症并改善血管健康。这一研究为运动通过靶向关键表观遗传机制改善内皮功能障碍和动脉粥样硬化提供了重要证据。
除了动脉粥样硬化,METTL14介导的m6A修饰还在其他心血管病理中发挥作用,例如缺血-再灌注(I/R)损伤,进一步巩固了METTL14的核心地位。例如,体外和动物研究表明,运动可以降低METTL14的表达,从而减少Phlpp2 mRNA的m6A修饰。这种调控激活了保护性Akt信号通路,抑制心肌细胞凋亡,并在保护心肌细胞免受I/R损伤和预防病理性心脏重塑中发挥关键作用。这些发现共同强调了METTL14在不同疾病模型中运动介导的心血管保护中的核心作用。最后,尽管METTL14在CVDs中的功能是当前研究的焦点,其他m6A相关蛋白(如WTAP)也已成为关键调控因子。例如,运动训练降低了训练大鼠中WTAP的水平,并通过YTHDF1/m6A/FOXO3a轴调控心肌I/R损伤的进展。此外,有氧运动通过调节m6A修饰改善了射血分数保留的心力衰竭(HFpEF)的心脏表型。
未来的研究需要综合讨论m6A修饰和运动效应是否具有器官或细胞类型特异性。尽管现有数据提供了坚实的基础,但探索这种特异性可以深化我们对运动诱导的m6A修饰如何促进心血管健康的理解。这些不断扩展的发现为理解运动诱导的RNA表观遗传调控如何用于广泛CVDs的治疗提供了新的途径。
总结
运动通过DNA甲基化、乳酸化修饰和m6A RNA修饰等多种表观遗传机制对心血管疾病产生系统性保护作用。然而,运动对心脏特异性表观遗传修饰的直接影响仍需进一步研究。未来的研究应深入探讨不同运动强度对表观遗传修饰的影响,以揭示运动在心血管疾病预防和治疗中的潜在机制。
运动介导的表观遗传效应是解决共病问题的重要手段
心血管疾病(CVDs)常与骨关节炎、2型糖尿病(T2D)和代谢功能障碍相关脂肪性肝病(MASLD)等疾病共存。这种合并症模式不仅对单一疾病的管理提出了挑战,还增加了传统药物治疗的复杂性。系统综述已证实运动疗法在合并症患者中的安全性和有效性,特别是在年轻患者中,运动干预显著改善了健康相关的生活质量。此外,运动还被证明能够减少基线抑郁水平较高个体的抑郁症状。值得注意的是,最近的一项研究通过表观遗传机制进一步阐明了运动的抗焦虑作用。这些发现表明,运动诱导的表观遗传修饰可能是运动对多系统、多器官益处的潜在机制。通过揭示这些机制,我们可以为个性化运动处方提供科学依据,确保精准干预的同时最大限度地降低运动损伤的风险。
以肝脏和心脏合并症为例,最近的研究探索了肝脏和心脏之间的复杂交互作用,特别是在心肌梗死(MI)和射血分数保留的心力衰竭(HFpEF)背景下。此外,研究还探讨了MI与MASLD之间的器官间通信,确定了潜在的治疗靶点,并帮助阐明了多器官相互作用的过程。一些研究推测,MASLD和HFpEF可能共享某些致病机制。运动不仅能改善肝脏脂肪变性和纤维化,还能降低糖尿病风险、增强胰岛素敏感性、减少炎症因子水平、降低心外膜脂肪组织厚度并改善心肺功能,且副作用极小。一项研究还表明,运动可以改善已有的非酒精性脂肪性肝炎(NASH)和纤维化,并通过器官间交互作用为心血管系统、脂肪组织和骨骼肌提供额外益处。当运动与饮食干预相结合时,效果更为显著。
在表观遗传水平上,运动通过cAMP/PKA/CREB途径诱导肝脏中Klf10的表达。肝细胞特异性敲除Klf10会导致喂食NASH饮食的小鼠脂质积累、细胞死亡、炎症和纤维化增加,削弱运动对NASH的保护作用。相反,肝细胞特异性过表达Klf10与运动协同作用,显著减少小鼠的NASH。从机制上讲,Klf10促进延胡索酸水合酶1(Fh1)的表达,从而减少肝细胞中延胡索酸的积累,进而降低脂质生成基因启动子处组蛋白H3K4三甲基化(H3K4me3)水平。这减少了脂质生成,改善了游离脂肪酸(FFA)诱导的肝细胞脂肪变性、凋亡和胰岛素抵抗,同时减弱了巨噬细胞和肝星状细胞的活化。目前尚不清楚Klf10的这些作用是否仅限于肝脏。有证据表明,Klf10在血管系统和心脏中也发挥保护作用。例如,它调节血管周围纤维化并抑制心脏甲基接受趋化蛋白I(MCP-1)的表达,从而缓解急性病毒性心肌炎。然而,运动介导的Klf10表达是否直接影响心脏功能尚不清楚,需要进一步研究。
此外,模拟运动效果的新兴疗法(运动模拟剂)已显示出作为预防和治疗CVDs的有效策略的潜力。进一步研究运动影响多系统和多器官的机制可能推动这些运动模拟剂的开发和应用。考虑到CVDs患者常伴有炎症或代谢紊乱,探索运动诱导的表观遗传修饰作为同时解决多种疾病的潜在方法具有重要意义。然而,目前关于运动如何通过表观遗传机制影响器官间交互作用的研究仍有限,这一领域需要进一步探索。
未来展望
尽管我们已经讨论了运动的多种心脏保护作用,但必须承认,运动作为心血管疾病(CVDs)的预防和治疗方法并非没有风险。研究表明,某些强度的运动可能会加速冠状动脉粥样硬化的进展,特别是极高强度运动和长时间耐力训练可能会加剧动脉粥样硬化。鉴于运动与表观遗传机制之间的密切关联,关注不同运动强度的表观遗传效应对于理解运动的两面性——其益处和潜在风险——至关重要。另一方面,运动介导的表观遗传学领域有望为CVDs及其合并症提供变革性见解。随着我们进一步揭示DNA甲基化、组蛋白修饰、非编码RNA(ncRNA)和RNA甲基化的复杂性,针对心血管病理的新治疗途径可能会涌现。然而,将这些表观遗传修饰转化为精确的、针对患者的干预措施仍然是一个关键挑战。
未来的研究应着重剖析运动诱导的表观遗传变化在不同组织和疾病状态之间的差异。越来越多的证据表明,运动介导的表观遗传效应在CVDs中发挥关键作用,影响几乎每个器官系统以改善健康或降低疾病风险。尽管运动在多种组织和器官中引发了有利的“细胞反应”,但驱动这些效应的潜在分子机制仍未得到充分阐明。另一个未来研究的关键领域是评估器官特异性表观遗传变化(如甲基化)在多大程度上可以在血液样本中反映出来。这些见解将有助于建立非侵入性生物标志物,用于监测运动诱导的器官特异性效应。此外,了解这些表观遗传修饰的持久性对于制定治疗和预防策略至关重要。运动诱导的表观遗传变化是短暂的还是持久的,可能显著影响其在CVDs中的潜在临床应用。特别值得注意的是,中性粒细胞在心肌梗死(MI)和心力衰竭(HF)中的线粒体稳态、炎症和组织修复过程中发挥关键作用。然而,运动是否能够影响这些功能尚不清楚,这使其成为未来研究的重要方向。
利用多组学策略为全面表征运动诱导的表观遗传变化提供了强有力的方法,从而有助于识别不同表观遗传修饰之间的复杂相互作用。最近来自MoTrPAC研究组的研究展示了多组学在理解运动如何促进系统健康方面的实用性。这些研究揭示了白色脂肪组织对运动的性别特异性反应,提供了运动训练后线粒体反应的多组学、多组织时间图谱,并证明了某些由运动诱导的调控网络在疾病中被下调。此外,时间分辨的多组学分析强调了运动期间的动态适应机制,包括对免疫、代谢、应激和线粒体通路的广泛调控。多组学方法的应用在阐明运动诱导的表观遗传变化的分子模式及其在器官间的相互作用方面显示出显著潜力。随着这一领域的进展,可能会识别出精确的生物标志物和治疗靶点,从而实现优化健康结果的个性化运动处方。
总之,将运动诱导的表观遗传学整合到临床实践中具有巨大潜力。对这些通路的深入理解使我们更接近制定精确的、个性化的方法,利用身体活动的益处不仅解决CVDs,还包括广泛的合并症。
参考文献
略
特别标注的参考文献
| No. | Reference | Annotation | Reason |
| [5] | Yang Q, Chen S, Wang X, et al. Exercise Mitigates Endothelial Pyroptosis and Atherosclerosis by Downregulating NEAT1 Through N6-Methyladenosine Modifications. Arterioscler Thromb Vasc Biol. 2023;43(6):910-926. doi:10.1161/atvbaha.123.319251 | ** | The study found that NEAT1 can serve as an important therapeutic molecular target for exercise treatment of cardiovascular diseases, providing new directions and theoretical foundations for exercise therapy and the prevention of coronary heart disease and other atherosclerosis-related diseases. |
| [12] | McGee SL, Hargreaves M. Epigenetics and Exercise. Trends Endocrinol Metab. 2019;30(9):636-645. doi:10.1016/j.tem.2019.06.002 | * | This review article systematically discusses the influencing factors of exercise regulation on epigenetics. |
| [76] | Hsu CC, Wang JS, Shyu YC, et al. Hypermethylation of ACADVL is involved in the high-intensity interval training-associated reduction of cardiac fibrosis in heart failure patients. J Transl Med. 2023;21(1):187. doi:10.1186/s12967-023-04032-7 | * | In research concerning the regulation of DNA methylation changes by exercise affecting cardiovascular diseases, this is one of the few studies that explore tissue-specific changes in the heart in both humans and in vitro experiments. |
| [77] | Xu GE, Yu P, Hu Y, et al. Exercise training decreases lactylation and prevents myocardial ischemia-reperfusion injury by inhibiting YTHDF2. Basic Res Cardiol. 2024;119(4):651-671. doi:10.1007/s00395-024-01044-2 | * | This is the first mechanistic study on the regulation of cardiac lactylation modifications mediated by long-term exercise and its downstream effects. |
| [104] | Aengevaeren VL, Mosterd A, Bakker EA, et al. Exercise Volume Versus Intensity and the Progression of Coronary Atherosclerosis in Middle-Aged and Older Athletes: Findings From the MARC-2 Study. Circulation. 2023;147(13):993-1003. doi:10.1161/circulationaha.122.061173 | * | The study found that certain levels of exercise intensity may accelerate the development of calcified plaques, providing important insights for future research on epigenetic modifications mediated by different intensities of physical activity. |
| [110] | Temporal dynamics of the multi-omic response to endurance exercise training. Nature. 2024;629(8010):174-183. doi:10.1038/s41586-023-06877-w | ** | An excellent paradigm for exploring the dynamic adaptation mechanisms mediated by exercise using multi-omics technologies. |
































